Infizierte Wunden, Wundinfektion erkennen und behandeln
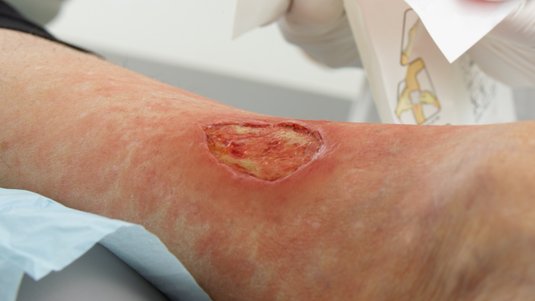
Was ist eine Wundinfektion? Eine Wundinfektion tritt auf, wenn Krankheitserreger in eine Wunde eindringen, eine Entzündung auslösen und die Heilung verzögern.
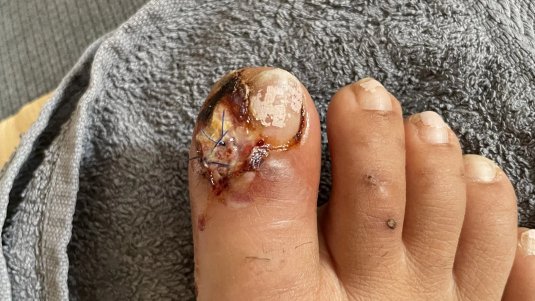
Typische Anzeichen einer Wundinfektion sind Überwärmung, Schmerzen, Rötung, Schwellung und Funktionseinschränkungen der betroffenen Stelle.
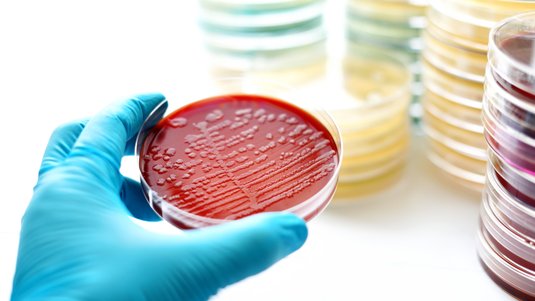
Vor allem chronische Wunden sind anfällig für das Eindringen von Keimen – hier lassen sich in der Regel die unterschiedlichsten Erreger nachweisen. Häufig findet man in infizierten, entzündeten Wunden die Bakterien Staphylococcus aureus und Pseudomonas aeruginosa.
Mit Blick auf mögliche Behandlungsansätze ist es bei Wunden generell wichtig, zunächst den Status des Erregerbefalls zu klären: Handelt es sich um eine Kontamination, Kolonisation oder um eine Infektion? Schlimmstenfalls kann es dabei sogar zu einer Generalisierung der Infektion (Sepsis) kommen, bei der sich die Infektion über die Wunde hinaus im gesamten Organismus ausbreitet. In diesem Fall ist eine rationale antibiotische Therapie indiziert.
Unter aseptischer Tätigkeit versteht man in der Wundversorgung Arbeitsschritte, die unter sterilen Bedingungen durchgeführt werden, um das Verschleppen oder Einbringen von Krankheitserregern möglichst zu verhindern.. Dazu gehört auch die Wundbettvorbereitung, einschließlich der Wundreinigung, um eine keimbefallene (septische) Wunde in eine saubere (aseptische) Wunde zu überführen. Bei aseptischen Tätigkeiten ist es entscheidend, höchste Hygienemaßnahmen einzuhalten. Dies umfasst beispielsweise eine strikte Desinfektion der Hände, die am Patienten arbeiten. Ein weiterer wichtiger Bestandteil ist die Non-Touch-Technik, bei der der Kontakt mit der Wunde und ihren umliegenden Bereichen so weit wie möglich vermieden wird, um eine Kontamination zu verhindern.
Eine infizierte Wunde ist grundsätzlich dadurch gekennzeichnet, dass sie die klassischen Zeichen einer Entzündung aufweist (Rötung, Überwärmung, Schwellung, Schmerz, ggf. Funktionsverlust). Eine starke Keimvermehrung kann diese und noch weitere Symptome auslösen. Es ist jedoch wichtig zu beachten, dass unter bestimmten Umständen, wie bei immungeschwächten Personen oder tiefen Wunden, die klassischen Entzündungszeichen fehlen können. Man unterscheidet zwischen einer lokalen und systemischen Infektion.
Welche Stadien der bakteriellen Besiedlung einer Wunde gibt es?
Jede Wunde weist eine gewisse Besiedelung mit Keimen auf. Häufig handelt es sich dabei um Keime unserer Hautflora, aber es können auch andere Mikroorganismen vorkommen. Die Besiedlung einer Wunde kann in folgende Stadien unterteilt werden, wobei die Übergänge zwischen diesen Stadien oftmals fließend sind:
- Kontamination: Bei der Kontamination sind Keime vorhanden und nachweisbar, diese vermehren sich allerdings nicht. Sie stellen aber keine Beeinträchtigung des Wirts dar, in diesem Fall des Menschen. Grundsätzlich ist jede (chronische) Wunde kontaminiert.
- Kolonisation: Bei einer Kolonisation vermehren sich die Keime in der Wunde. Es ist jedoch keine klinisch relevante Wirtsreaktion zu erkennen.
- Kritische Kolonisation: Von einer kritischen Kolonisation war bisher die Rede, wenn es zu einer Vermehrung der Keime kommt, die zwar noch keine systemische Immunreaktion auslöst, jedoch die Heilung chronischer Wunden verzögern kann. Dieser Begriff wird heute jedoch immer seltener verwendet, da eine kritische Kolonisation klinisch schwer zu identifizieren ist.
- Infektion: Eine Infektion ist dadurch definiert, dass die Wunde die klassischen Zeichen einer Entzündung aufweist (Rötung, Überwärmung, Schwellung, Schmerz, ggf. Funktionsverlust) und sich, getriggert durch die starke Keimvermehrung, eine systemische Wirtsreaktion einstellt. Man unterscheidet eine lokale von einer systemischen Infektion:
- Bei einer lokalen Infektion weisen Wunde und Wundumgebung die typischen Infektionszeichen auf. Es stellt sich eine immunologische Wirtsreaktion ein.
- Bei einer systemischen Infektion kommen zusätzlich zu den lokalen Symptomen noch weitere systemisch auftretende Reaktionen hinzu. Dazu zählen beispielsweise eine Leukozytose, der Anstieg des C-reaktiven Proteins sowie Fieber.
Der Begriff „kritisch kolonisiert“ ist weder klinisch noch mikrobiologisch definierbar. Daher sprechen sich mittlerweile verschiedene Experten und Expertinnen gegen die Verwendung dieses Begriffs aus. Bereits 2021 wurde in der Publikation "Diagnostik und Therapie lokaler Wundinfektionen" von Prof. Dr. med. Dissemond darauf hingewiesen, dass der Begriff "kritische Kolonisation" zunehmend kontrovers diskutiert wird.2 Im Jahr 2023 erschien der Artikel „Schwer heilende und chronische Wunden: Mit komplexen Konzepten zur Abheilung“ von Frau Prof. Dr. med. Stürmer et al. im deutschen Ärzteblatt.7 In dem Artikel wird auf den Consensus aus dem Jahr 2022 des „International wound infection institute“ Bezug genommen. Dort steht, dass der Begriff international nicht mehr verwendet werden sollte.
Video: Handschuhe im Praxisalltag
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.
Hygienemanagement in der Arztpraxis
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.
Behandlung und Therapie einer Wundinfektion
Ziel der Behandlung einer infizierten Wunde ist, sie in eine saubere, offene Wunde zu überführen, um anschließend eine standardisierte Wundversorgung durchführen zu können.
Eine gründliche Reinigung oder ein Débridement ist dabei entscheidend, um nekrotisches Gewebe und Beläge zu entfernen. Je nach Wundsituation kann eine Abstrichentnahme erforderlich sein, um den Erreger zu identifizieren und gezielt behandeln zu können.
Frühe Stadien: Kontamination und Kolonisation
In den Stadien der Kontamination oder Kolonisation reicht eine einfache Wundreinigung, beispielsweise mit physiologischer Kochsalzlösung, aus, da keine klinisch relevante Infektion vorliegt. Eine antiseptische Behandlung ist in diesen frühen Stadien nicht erforderlich.
Kritische Kolonisation und Infektion
Zeigen sich Anzeichen einer kritischen Kolonisation, wie verzögerte Wundheilung oder vermehrte bakterielle Belastung, sollte der Einsatz von Antiseptika erfolgen, um eine Infektion zu verhindern. Bei infizierten Wunden ist eine Kombination aus Débridement und antiseptischer Behandlung erforderlich, um die Infektionserreger zu bekämpfen und die Wundheilung zu unterstützen. Der Begriff „kritische Kolonisation“ wird allerdings zunehmend nicht mehr verwendet (siehe Infobox), da eine kritische Kolonisation klinisch nicht zu fassen ist. Daher stehen dem Fachpersonal unterstützend der W.A.R-Score ("wound-at-risk") sowie der TILI-Score ("Therapeutischer Index für lokale Infektionen") zur Verfügung, um Infektionsrisiken zu identifizieren, beziehungsweise Wundinfektionen frühzeitig erkennen und effizient behandeln zu können.
Septisch bedeutet, dass eine Wunde keimbehaftet ist, aseptisch hingegen geht von einer Keimfreiheit aus. Genau genommen gibt es jedoch keine Wunde, die gänzlich frei von Keimen ist. Wunden, die durch aseptische Operationen entstanden sind, gelten jedoch als aseptische Wunden. Dazu zählen auch Einstichstellen von Kathetern, z. B. zentrale Venenkatheter.
Reinigung und Verbandwechsel
Bei jedem Verbandwechsel sollte jede Wunde gründlich gereinigt werden. Nach aktueller Expertenmeinung erfolgt die Wundreinigung idealerweise von innen nach außen, um eine zusätzliche Keimverschleppung in die Wunde zu vermeiden. Je nach Wundsituation ist ebenfalls die Durchführung eines Débridements notwendig. Bakterielle Beläge können mitunter schwer zu erkennen und ebenfalls schwer zu entfernen sein. Auch hier hilft ein regelmäßiges Débridement dabei, die Keimlast auf Dauer zu reduzieren.
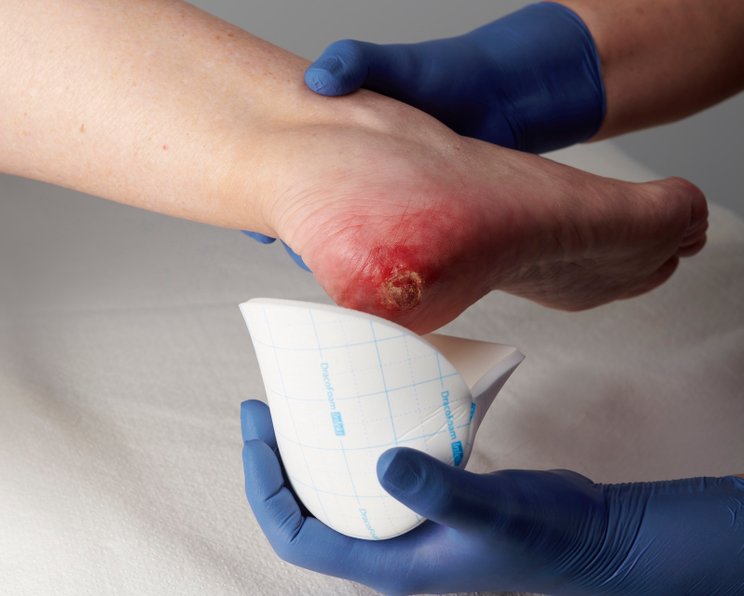
Einsatz von Wundauflagen
Für die Behandlung infizierter Wunden stehen spezielle Wundauflagen zur Verfügung. Die geeignete Wundauflage erfüllt zwei zentrale Funktionen: Sie nimmt das Wundexsudat auf und reduziert die Infektionserreger. Hier sind antimikrobielle Wundauflagen das Mittel erster Wahl.
Dekontamination, Desinfektion, antiseptische Wundbehandlung - wo liegt der Unterschied?
Die Dekontamination beschreibt vor allem die Keimreduktion durch Entfernen kontaminierten (mit Erregern verunreinigten) Gewebes (z. B. Nekrosen) und kontaminierter Wundflüssigkeit. Die Keime sollen so weit reduziert werden, dass eine möglichst ungehinderte Wundheilung möglich ist.
Bei der Desinfektion hingegen steht die Abtötung der Keime im Vordergrund, beispielsweise prophylaktisch (wenn es nach einem Sturz zu einer Verschmutzung der Wunde gekommen ist) oder aber als therapeutische Maßnahmen bei einer bereits manifestierten Infektion. Mittlerweile wird der Begriff der Desinfektion jedoch im Bereich der Wundversorgung immer weniger verwendet. Heute spricht man eher von einer antiseptischen Wundbehandlung, bei der eben Antiseptika als Mittel zur Abtötung oder Inaktivierung von Keimen eingesetzt werden.
Behandlung mit Wundantiseptika
Zur Reduktion der Keimzahl einer Wunde stehen verschiedene Antiseptika zur Verfügung. Für die Behandlung chronischer Wunden werden aktuell drei Wirkstoffe empfohlen: Polihexanid (PHMB), Octenidin und Natriumhypochlorit/Hypochlorit (NaOCl/HOCl).
Alle drei Substanzen zeigen ein gutes Wirkspektrum gegenüber grampositiven und gramnegativen Bakterien. Unverträglichkeiten sind bislang nur in Einzelfällen berichtet worden.
Povidon-Jod (PVP-Iod) hingegen wird für die Behandlung chronischer Wunden nicht mehr empfohlen. Zudem sollte es nicht zusammen mit Octenidin verwendet werden, da es zu violetten Verfärbungen der Wunde kommen kann.
Für akute, kontaminierte traumatische Wunden, insbesondere bei einer Kolonisierung mit multiresistenten Erregern (MRE), wird die Verwendung von Octenidin empfohlen. Allerdings besitzt Octenidin ein hohes zytotoxisches Potenzial und sollte daher nicht in Taschen, Fisteln oder Höhlen injiziert und dort belassen werden, da dies zu ausgedehnten Nekrosen führen kann. Natriumhypochlorit/Hypochlorit eignet sich gut zur mehrmaligen antiseptischen Reinigung der Wunde und ermöglicht sogar die Dekolonisation von MRSA. Am verträglichsten ist nach der aktuellen Datenlage Polihexanid, welches sogar die Wundheilung fördern kann. Ein Nachteil ist die längere Einwirkzeit von etwa 15–20 Minuten, was jedoch bei chronischen Wunden in der Regel akzeptabel ist.
Bisher existieren nur wenige Daten, die eine klare Aussage zur antiseptischen Wundbehandlung zulassen, weshalb viele Empfehlungen auf Expertenmeinungen beruhen. Die Auswahl eines geeigneten Antiseptikums sollte stets unter Berücksichtigung der individuellen Wundsituation erfolgen. Dabei spielen Faktoren wie die Belastung durch Keime, die Widerstandsfähigkeit des Gewebes, das Wundstadium (akut oder chronisch) sowie die Behandlungsabsicht (präventiv oder therapeutisch) eine entscheidende Rolle.
Antiseptika haben das primäre Ziel, eine Sepsis, die mitunter lebensbedrohlich sein kann, zu verhindern. Entsprechend ist die Anforderung an diese Wirkstoffe, dass sie Krankheitserreger abtöten, ohne dem Patienten dabei zu schaden. Dennoch sind Antiseptika kein universelles Heilmittel und sollten mit Vorsicht eingesetzt werden. Denn es besteht immer die Gefahr, dass sich gegen die entsprechenden Substanzen Resistenzen entwickeln, einige können zudem allergische Reaktionen hervorrufen. Entsprechend wichtig ist es, dass die Anwendung nur bei entsprechender Indikation und nur über einen kurzen Zeitraum erfolgt. Die Anwendungsdauer von Antiseptika richtet sich dabei nach den Vorgaben der Hersteller. In der Regel sollten Wunden jedoch nicht länger als 14 Tage damit behandelt werden. Geht die Infektion in dieser Zeit nicht zurück, sollte die Therapie überdacht und angepasst werden.
WundantiseptikaSystemische antibiotische Therapie
In der Regel wird bei einer lokal infizierten Wunde keine antibiotische Therapie eingeleitet. Droht diese allerdings in eine systemische Infektion überzugehen, ist eine antibiotische Therapie notwendig. Die Entscheidung für die Therapie liegt bei der Ärzteschaft. Die Behandlung von Wundinfektionen mit topischen Antibiotika gilt als obsolet.
Eine systemische Antibiose sollte idealerweise auf einem zuvor erstellten Resistogramm basieren. Dieses Verfahren identifiziert den bakteriellen Erreger und dessen Empfindlichkeit gegenüber verschiedenen Antibiotika. Muss die Therapie aus klinischen Gründen bereits vor Vorliegen des Resistogramms begonnen werden, ist es von Vorteil die Resistenzsituation im eigenen Umfeld/in der eigenen Klinik zu kennen. Entsprechende Statistiken werden von mikrobiologischen Instituten in der Regel jährlich erstellt.
Kommt es zu einer systemischen Infektion, ist ein Antibiotikum Mittel der Wahl. Angesichts weiter steigender Resistenzen von MRSA (Methicillin-resistenter Staphylococcus aureus) und ESBL (Extended-Spectrum-Betalaktamasen) gegenüber diversen Antibiotika sollten diese jedoch nicht leichtfertig eingesetzt werden. Eine lokale Behandlung mit Antibiotika in der Wunde ist ebenfalls nicht mehr zeitgemäß und fördert Resistenzen, die es zu vermeiden gilt. So stellt eine infizierte Wunde ohne auftretende Entzündung an sich keine direkte Indikation für den Einsatz des Arzneimittels dar. Die lokale Behandlung infizierter Wunden sollte daher zunächst mit antiseptischen Substanzen erfolgen.
Woran erkennt man eine infizierte Wunde?
Eine lokale Infektion ist an den folgenden Entzündungszeichen erkennbar:
- Rötung (Rubor)
- Schwellung (Tumor)
- Wärme (Calor)
- Schmerzen (Dolor)
- Bewegungseinschränkung (Functio laesa)
Diese primären Entzündungszeichen sind jedoch vor allem bei chronischen Wunden teilweise nicht so eindeutig zu erkennen, deswegen haben Experten der Initiative Chronische Wunden e.V. (ICW) einen in der Praxis einfach anzuwendenden Score für die Diagnostik entwickelt, den TILI-Score (Therapeutischer Index für lokale Infektionen). Zudem gibt es zur Identifizierung von Patientinnen und Patienten mit infektionsgefährdeten Wunden den W.A.R-Score ("wound-at-risk").
Treten neben den lokalen Entzündungszeichen auch Symptome wie Fieber, Nachtschweiß oder ein allgemeines Krankheitsgefühl auf, deutet dies auf eine Ausbreitung der Infektion hin. In solchen Fällen ist es wahrscheinlich, dass sich die lokale Infektion zu einer systemischen entwickelt hat.
Video: Infizierte Wunden
Erfahren Sie in unserem „Wundwissen kompakt“ Video alles Wichtige über infizierte Wunden:
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.
Diagnostik von infizierten Wunden
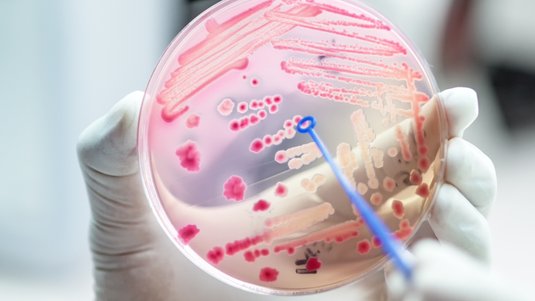
Abstriche
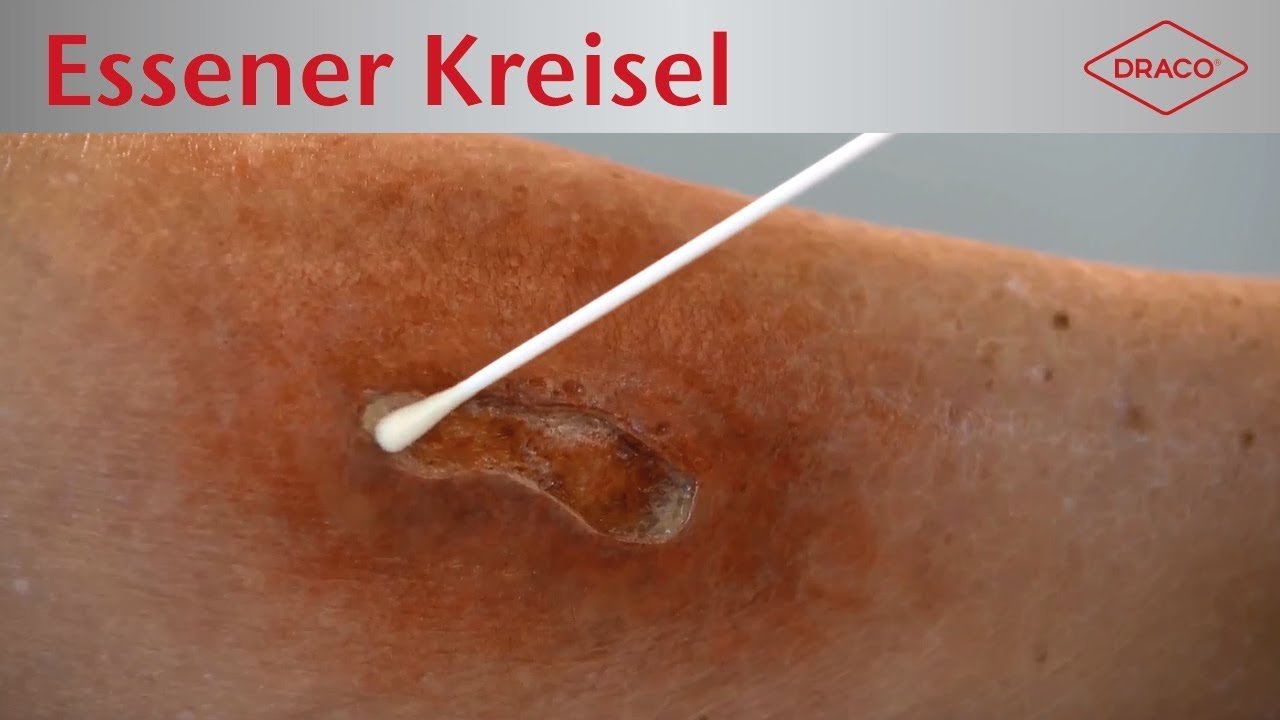
Besteht der Verdacht auf eine Kolonisation oder Infektion der Wunde mit Erregern, sollten Abstriche durchgeführt werden. Dafür wird für Screeninguntersuchungen zum Nachweis Multiresistenter Erreger der Essener Kreisel empfohlen (ohne vorherige Wundreinigung). Zum anderen gibt es die Levine-Technik, die in der Regel für allgemeine Erregernachweise bei klinischer Infektion (nach einer Wundreinigung mit beispielsweise NaCl aber vor einer antiseptischen Behandlung).
Biopsie
Bei einer Biopsie werden mittels Hohlnadel oder Stanze Gewebe- oder Flüssigkeitsproben entnommen. Bei Verwendung einer Hohlnadel befinden sich im Inneren der Nadel das zu untersuchende Gewebe oder einzelne Zellen. Bei der Feinnadelbiopsie wird Körperflüssigkeit z. B. aus einer Fistel gesaugt, bei einer Stanzbiopsie werden größere Gewebeteile entnommen. Die Probe wird anschließend ins Labor geschickt.
Die Entnahme von Biopsien zur Erregerdiagnostik ist für die meisten Patientinnen und Patienten mit chronischen Wunden nicht erforderlich. Biopsien sollten jedoch durchgeführt werden bei:
- Wundinfektionen von tiefen Wunden (z. B. tiefe Ulzerationen oder diabetische Fußulcera (DFU))
- Wundinfektionen ohne Erregernachweis im Abstrich
- schweren Weichgewebeinfektionen
- Fistelgewebe
- Verdacht auf spezifische Erreger wie Mykobakterien, Leishmanien oder Schimmelpilze
- keiner Heilungstendenz nach 12 Wochen adäquater Kausaltherapie
Video: Essener Kreisel
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.
Welche Erreger rufen eine Wundinfektion hervor?
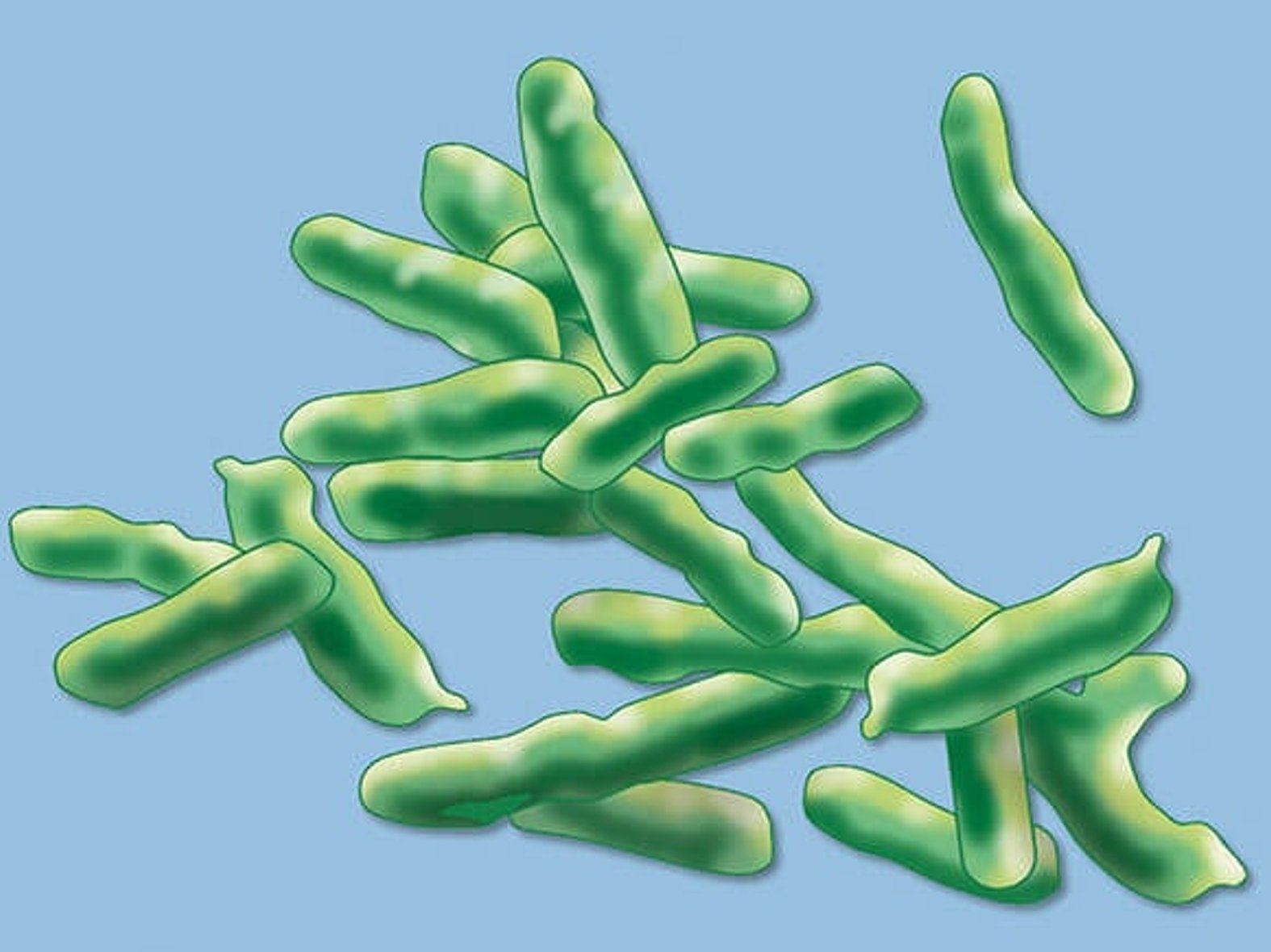
Für die Entstehung einer Wundinfektion können unterschiedlichste Erreger verantwortlich sein. Mittels Wundabstrich sind viele Arten nachweisbar. Es werden häufig grampositive oder gramnegative Bakterien in Kokkenform gefunden, die sowohl in aerober als auch in anaerober Form vorkommen können. Zudem sind auch grampositive oder gramnegative Anaerobier sowie Hefepilze nachweisbar.
Die beiden häufigsten Erreger sind:
- Staphylococcus aureus
- Pseudomonas aeruginosa
Mittlerweile werden zunehmend multiresistente Keime in chronischen Wunden gefunden. Dazu zählen zum Beispiel Methicillin-resistente Staphylococcus aureus (MRSA), Glykopeptid- oder Vancomycin-resistente Enterokokken (GRE oder VRE) bzw. multiresistente gramnegative Bakterien (MRGN).
In offenen Wunden finden Mikroorganismen gute Wachstumsbedingungen vor. Sie benötigen konstante Temperaturen und ausreichend Nährstoffe, wie Kohlenhydrate und Eiweiße, Wasser und aerobe Bakterien auch kontinuierlich Sauerstoff. Das Wundexsudat liefert die Nährstoffe und das Wasser, die Körperwärme fungiert wie ein Treibhaus und der Sauerstoff wird über die Umgebung zugeführt.
Es gibt verschiedene Erkrankungen, die mit einem geschwächten Immunsystem einhergehen. Dadurch werden dann Infektionen mit Bakterien oder Viren erleichtert. Dazu gehören Autoimmunerkrankungen wie Diabetes mellitus, Psoriasis oder Lupus erythematodes. Auch das Alter an sich kann zu einem schwächeren Immunsystem führen. Immunsupprimierende Medikamente wie Cortison können ebenfalls die Infektionsgefahr erhöhen.
Die Wahrscheinlichkeit einer Wundinfektion hängt von unterschiedlichen Faktoren ab:
- Art der Wunde (z. B. akut oder chronisch)
- Anzahl und Ansteckungsfähigkeit der Erreger
- Grunderkrankungen, die das Immunsystem schwächen
- Immunstatus (z. B. durch Medikation)
Gefährdete Körperstellen
Jede Wunde, unabhängig von der Körperstelle, kann sich entzünden. Besonders gefährdet sind die, die in enger Nähe zu bakterienreichen Regionen wie dem Analbereich liegen. Mangelnde Hygiene kann aber zur Infektion jeder Wunde am Körper führen. Mit einer offenen Wunde sollte jedoch nicht geduscht werden. Hintergrund ist, dass es aufgrund verschiedener Umstände (z. B. abgestandenes Wasser in der Leitung oder (Kalk-) Ablagerungen an den Duscharmaturen) zu einer vermehrten Keimbildung im Wasser kommen kann. Gelangen diese Keime in die Wunde, können sie eine Infektion auslösen. Dies kann dazu führen, dass die Wundheilung stagniert. Zusätzlich besteht die Gefahr, dass physiologische Keime der Haut in die Wunde gespült werden und sich dort vermehren können.
Abhilfe können hier Duschköpfe mit einem integrierten Filtersystem schaffen. Diese sind nicht kostengünstig, werden aber unter Umständen von der Krankenkasse übernommen. Wichtig ist, im Vorfeld eine entsprechende Genehmigung einzuholen.
Mögliche Komplikationen einer Wundinfektion
Nimmt die Bakterienlast weiter zu, kann sich die lokale Wundinfektion zu einer systemischen Infektion ausweiten. Zu den Symptomen zählen neben Fieber auch Nachtschweiß und ein allgemeines Krankheitsgefühl. Eine systemische Infektion kann unbehandelt zu einer lebensbedrohlichen Sepsis werden. Eine gezielte Behandlung mit Antibiotika ist in diesem Fall unerlässlich, um ein Organversagen zu verhindern. Die Sepsis ist ursächlich für eine Vielzahl von Todesfällen, besonders bei älteren und geschwächten Patienten.
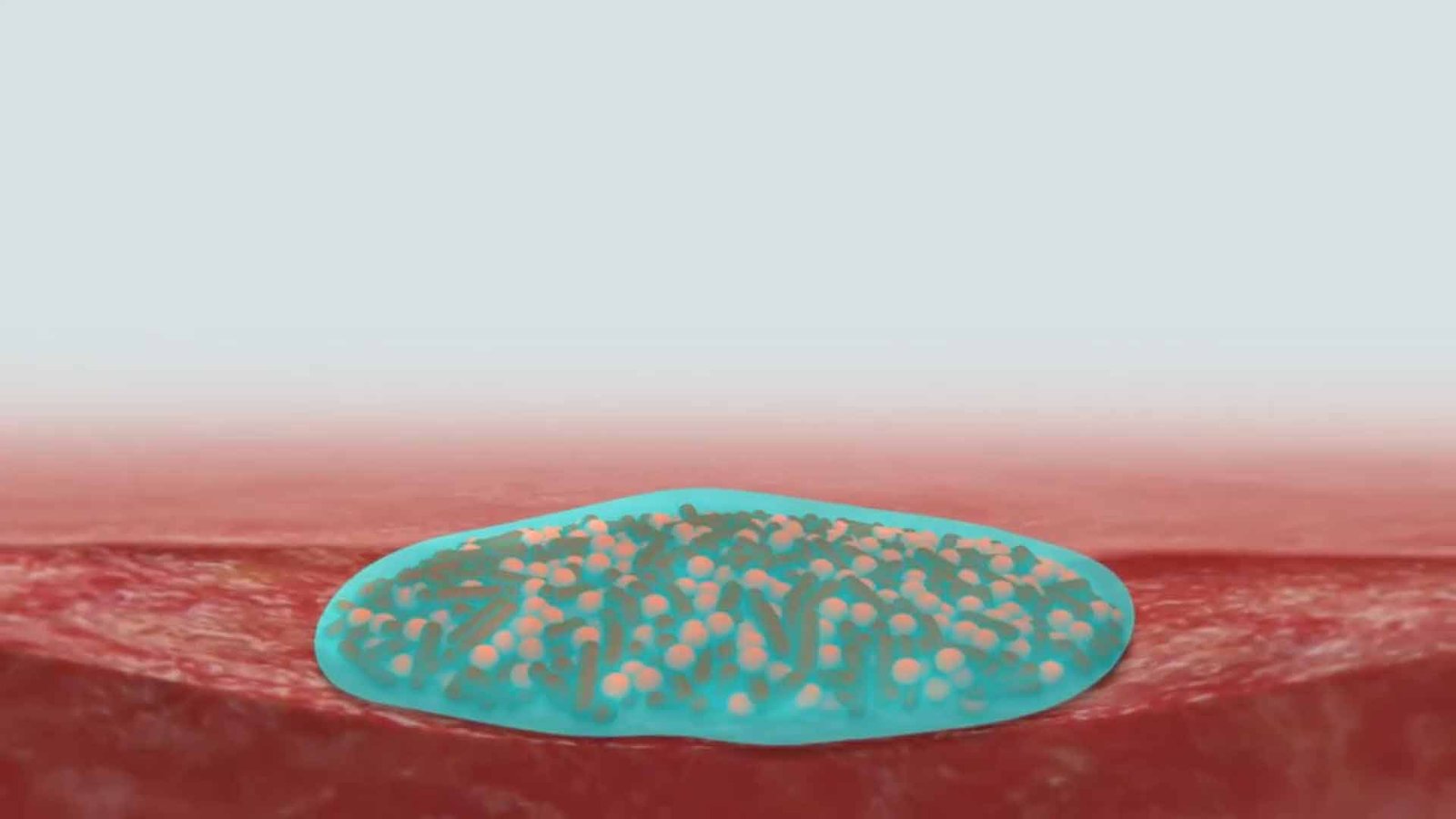
Bedeutung von Biofilm bei Wundinfektionen
Ein Biofilm ist eine von Bakterien gebildete Matrix, die sich fest an Oberflächen anlagert und eine schleimartige Konsistenz hat. Er besteht aus verschiedenen gelbildenden Substanzen und Nährstoffen wie Polysacchariden, Proteinen, Lipiden und Bakterien-DNA. Innerhalb des Biofilms sind die Bakterien geschützt und können sich ungehindert vermehren. Der Biofilm kann sich kontinuierlich vermehren und an unterschiedliche Umgebungen anpassen.
Antiseptische Lösungen können nur begrenzt in diese Schutzschicht eindringen und erreichen die Bakterien nur oberflächlich. Daher bleibt trotz Antispetikabehandlung eine Keimlast bestehen, die eine Vermehrung der Bakterien und des Biofilms weiter ermöglicht. Zudem können Bakterien innerhalb des Biofilms Resistenzen gegen Antiseptika und Antibiotika austauschen, was die Behandlung zusätzlich erschwert. Da Antiseptika nur bedingt wirksam sind, ist eine frühzeitige Intervention – beispielsweise durch mechanisches Débridement – entscheidend, um das Wachstum der Mikroorganismen zu stören und die Keimlast zu reduzieren.
Hygienemaßnahmen sind im Falle einer Wundkontamination oder Kolonisation das Mittel der Wahl.
Oberste Priorität hat eine gründliche Händedesinfektion und eine sterile Arbeitsweise zur Vermeidung einer weiteren Übertragung und Ausbreitung von Keimen. Aktuelle Studien zeigen, dass eine gründliche Händedesinfektion die Ausbreitung von MRSE deutlich reduzieren kann und hilft, Infektionsrisiken zu mindern und Versorgungskosten zu reduzieren.
Neben den Händen sind auch Kontaktflächen des Patienten, medizinische Instrumente sowie persönliche Gegenstände mindestens einmal pro Tag zu reinigen. Hygieneartikel wie Zahnbürsten, Cremes etc. sollten entsorgt und ersetzt werden. Im häuslichen Bereich sollten Tiere zum Zeitpunkt des Verbandwechsels den Raum verlassen. Regelmäßige Wäsche von körpernaher Kleidung und Bettwäsche reduziert die Gefahr, sich selbst zu kontaminieren.
Video: Vermehrung von Biofilm auf einer Wunde
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.
Video: Biofilm entfernen, aber wie?
Bei Start des Videos werden Informationen an YouTube/Google übermittelt. Mehr hierzu unter: Google Datenschutzerklärung.